非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是全球最常见的慢性肝病,影响约30%的成年人。其疾病谱涵盖从单纯性脂肪肝(non-alcohol-associated fatty liver,NAFL)变性到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)的进展过程。NASH是NAFLD的炎症性亚型,以肝细胞脂肪变性、小叶炎症、肝细胞气球样变和纤维化为特征,约20%的NAFL患者会进展为NASH。若未及时干预,NASH可进一步发展为肝硬化、肝衰竭或肝细胞癌(hepatocellular carcinoma,HCC),成为肝移植的重要病因之一。值得注意的是,NASH不仅限于肝脏病变,还与代谢综合征(肥胖、2型糖尿病、心血管疾病)密切相关。其核心病理机制涉及脂毒性、胰岛素抵抗、线粒体功能障碍和炎症信号激活。
尽管NASH的临床负担日益加重,目前治疗手段仍以生活方式干预(饮食控制、运动)为主。2024年获批的首个NASH靶向药物Resmetirom(甲状腺激素受体β激动剂)虽可改善肝脂肪变性和纤维化,但其长期安全性(如甲状腺功能异常风险)仍需监测。因此,开发多靶点、低毒性的新型疗法成为当务之急。
AMP活化蛋白激酶(AMPK)是真核生物中高度保守的能量传感器,由催化亚基α(α1/α2)、调节亚基β(β1/β2)和γ(γ1-γ3)组成。其在细胞能量稳态调控中发挥核心作用:当细胞内AMP/ATP比值升高(如能量不足)时,AMPK被激活,通过磷酸化下游靶点促进分解代谢(如脂肪酸氧化、糖酵解),同时抑制合成代谢(如脂质合成、糖异生)。
AMPK在NASH中有如下保护机制:
·抑制脂肪合成:磷酸化并抑制乙酰辅酶A羧化酶(ACC),减少丙二酰辅酶A生成,解除对肉碱棕榈酰转移酶1(CPT1)的抑制,促进脂肪酸进入线粒体β氧化。抑制固醇调节元件结合蛋白1c(SREBP1c)的转录活性,减少脂肪酸和甘油三酯的合成。
·促进脂肪酸氧化:激活过氧化物酶体增殖物激活受体α(PPARα),上调线粒体和过氧化物酶体中的β氧化酶类(如ACOX1)。
·抗炎作用:抑制NF-κB通路的激活,减少TNF-α、IL-6等促炎因子释放。
·改善胰岛素敏感性:增强胰岛素受体底物(IRS)的酪氨酸磷酸化,促进葡萄糖转运体GLUT4的膜转位。
近年研究发现,AMPK与沉默信息调节因子1(SIRT1)存在双向调控:AMPK通过增加NAD+水平激活SIRT1(去乙酰化酶),而SIRT1通过去乙酰化LKB1(AMPK上游激酶)增强AMPK活性。这一正反馈环路在改善代谢紊乱中具有协同效应。然而,肥胖、高脂饮食等代谢压力可导致AMPK/SIRT1信号受损,加剧NASH进展。因此,靶向激活AMPK/SIRT1通路成为治疗NASH的潜在策略。
多花黄精(Polygonatum cyrtonema Hua)是黄精属多年生植物,在《中国药典》中记载有“补脾润肺、益气养阴”之效。现代药理学研究表明,其富含多糖、黄酮、皂苷和生物碱等活性成分,具有抗氧化、抗炎、免疫调节及降脂作用。前期的研究表明黄精多糖可通过调节肠道菌群改善NAFLD小鼠的肝脂肪变性;槲皮素(黄精主要黄酮成分)可激活AMPK,抑制SREBP1介导的脂肪合成。尽管黄精提取物在动物模型中显示抗NASH潜力,但其具体活性成分、多组分协同机制及AMPK/SIRT1通路的调控作用尚未系统阐明。
论文“Ethanol extract of Polygonatum cyrtonema Hua mitigates non-alcoholic steatohepatitis in mice”《Frontiers in Pharmacology》(JCR分区:Q1,影响因子:4.4)报道:通过整合代谢组学(UHPLC-MS/MS)、转录组学(RNA-seq)与分子生物学手段,首次揭示黄精乙醇提取物(PCE)通过激活AMPK/SIRT1通路,改善高脂饮食诱导的小鼠NASH的分子机制,为传统中药的现代化开发提供科学依据。研究聚焦两大科学问题,即黄精乙醇提取物中含哪些关键代谢物以及PCE如何通过AMPK/SIRT1通路改善NASH的脂代谢紊乱与炎症?

1. PCE的化学组成分析
通过超高效液相色谱-串联质谱(UHPLC-MS/MS)技术,研究团队从PCE中鉴定出211种代谢物(图1A-B),涵盖多糖、黄酮、皂苷、生物碱等多种活性成分。其中9种代谢物被文献证实具有显著降脂作用,包括黄芩苷(Baicalin)、槲皮素(Quercetin)、橙黄决明素(Aurantio-obtusin)、白术内酯(Atractylenolide)、山姜素(Alpinetin)、异鼠李素(Isorhamnetin)、土大黄苷(Rhaponticin)、秦皮甲素(Esculin)和草夹竹桃苷(Androsin)等,其MS/MS片段离子谱见图1C,这些成分的协同作用可能为PCE的多靶点效应奠定化学基础。
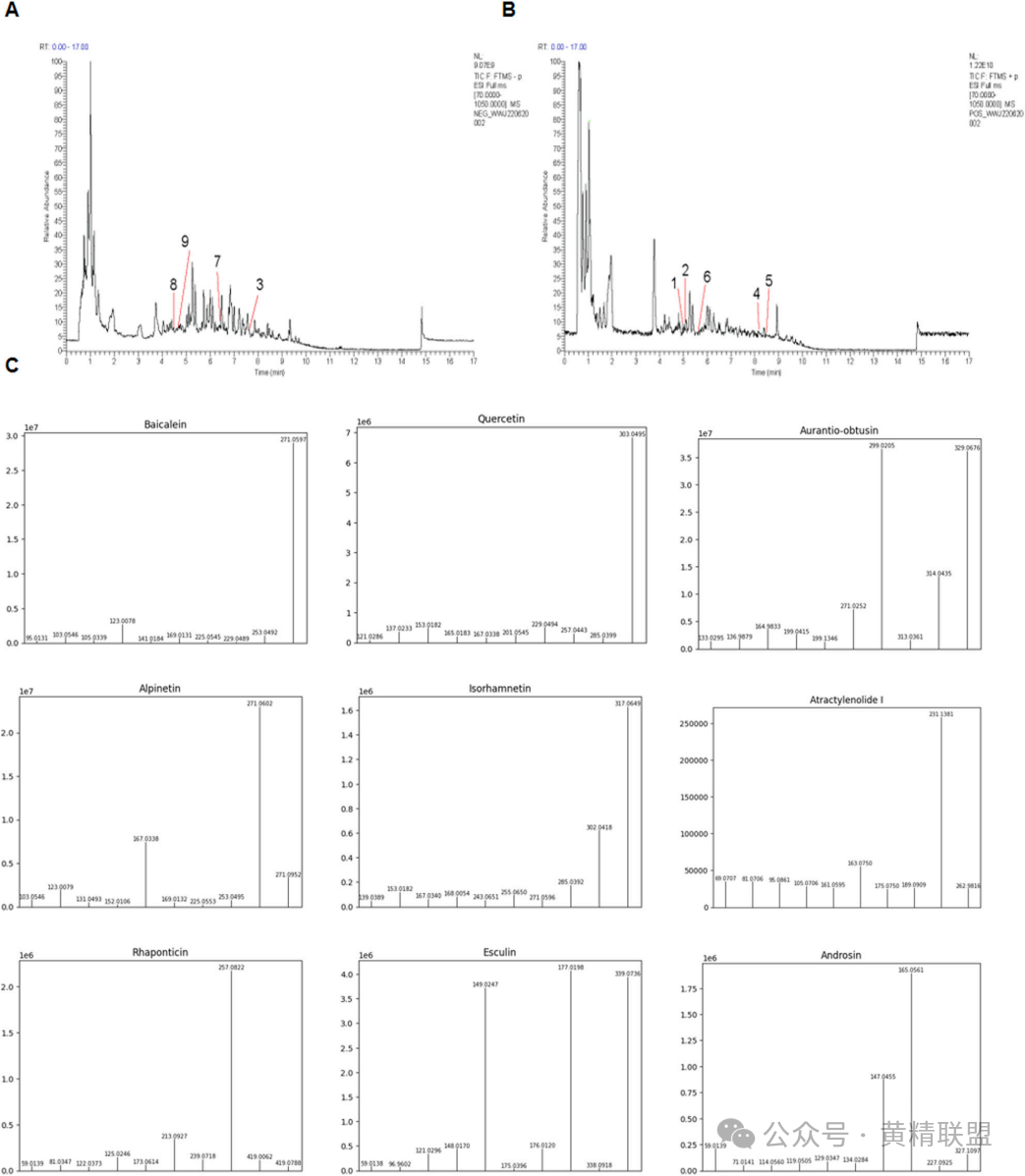
图1 PCE的总色谱图
(A)PCE的负离子源色谱;(B)PCE的色谱正离子源;(C)UHPLC-ESI-MS/MS谱图显示PCE的降脂代谢产物。
2. PCE改善NASH小鼠表型与肝脏病理
高脂饮食(HFD)组小鼠体重较正常组增加42%,肝指数(肝重/体重)升高58%(图2C-D)。高剂量PCE(900 mg/kg)干预4周后,体重增幅降低至27%,肝指数恢复至接近正常水平,效果与阳性药辛伐他汀(Simvastatin)相当。肝脏形态学观察,HFD组肝脏呈明显黄色(脂质沉积)、体积增大,而PCE治疗组肝脏颜色和体积逐步恢复正常(图2B)。苏木精-伊红染色(图3A)显示HFD组肝细胞广泛脂肪空泡化(空泡面积占比35%)和气球样变(细胞肿胀破裂),PCE高剂量组空泡面积降至8%(p<0.01);油红O染色显示HFD组脂滴面积占比达45%,PCE高剂量组降至12%,接近正常水平(图3A)。
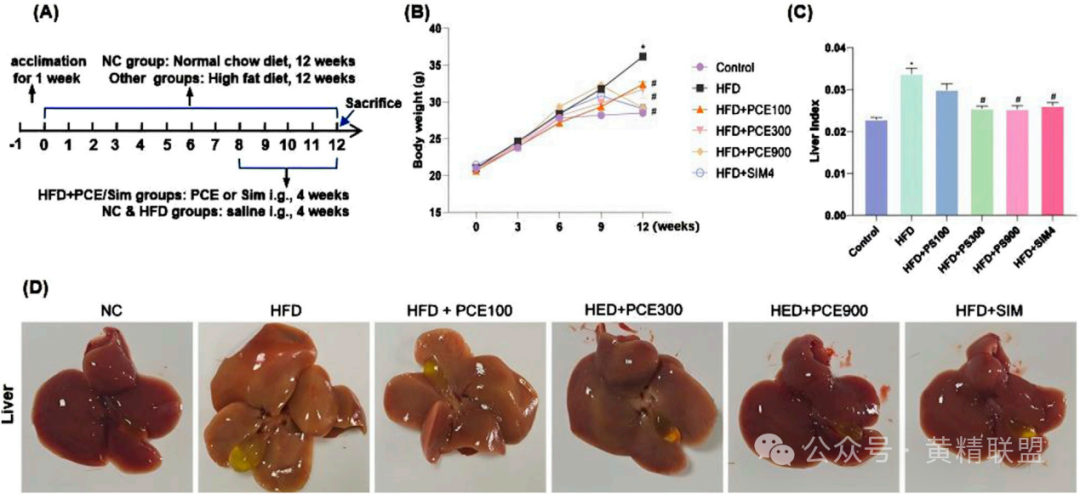
图2 PCE减轻HFD诱导的小鼠体重和肝脏指数的增加
(A)HFD诱导NASH小鼠的时间建模过程模型;(B)肝脏形态的代表性图片;(C)每周体重测量曲线;(D)肝脏指数(肝脏/体重,g/g)。
3. PCE纠正脂代谢紊乱与肝功能损伤
血清生化指标(图3B-G)显示HFD组的肝损伤标志物丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平分别升高至正常组的2.8倍和3.1倍,PCE高剂量组分别降至1.3倍和1.5倍。HFD组的甘油三酯(TG)较正常组升高2.5倍,PCE高剂量组降低48%。HFD组的总胆固醇(TC)升高2.2倍,PCE高剂量组降低35%。PCE显著上调高密度脂蛋白胆固醇(HDL-C,↑30%)并降低低密度脂蛋白胆固醇(LDL-C,↓50%),表现出其良好的改善脂质逆向转运能力。

图3 PCE治疗缓解了HFD诱导的肝损伤和肝脂肪变性
(A)代表性H&E染色图像和油红O染色图像(200×,中间面板是H&E染色图像的部分放大图);(B)血清ALT;(C)血清AST;(D)Serun TC;(E)血清TG;(F)血清高密度脂蛋白(HDL-C);(G)血清低密度脂蛋白(LDL-C)。
4. PCE激活AMPK/SIRT1通路调控脂代谢
通过蛋白免疫印迹(Western blot)与qPCR验证研究表明(图4A-F),HFD组p-AMPK/AMPK比值下降50%,PCE高剂量组恢复至正常水平。SIRT1表达方面,HFD组SIRT1蛋白表达降低60%,PCE高剂量组上调2.1倍。脂合成调控因子(SREBP1)蛋白表达降低65%,其靶基因(如ACC)的mRNA水平同步下降,从而抑制脂肪的合成。PPAR α蛋白表达升高1.8倍,其调控的线粒体β氧化酶(如CPT1A)mRNA水平上升,促进脂肪酸氧化。微粒体甘油三酯转移蛋白(MTTP)和载脂蛋白B(ApoB)表达回升至正常组的80%,促进低密度脂蛋白胆固醇分泌,使得脂质外排增强。
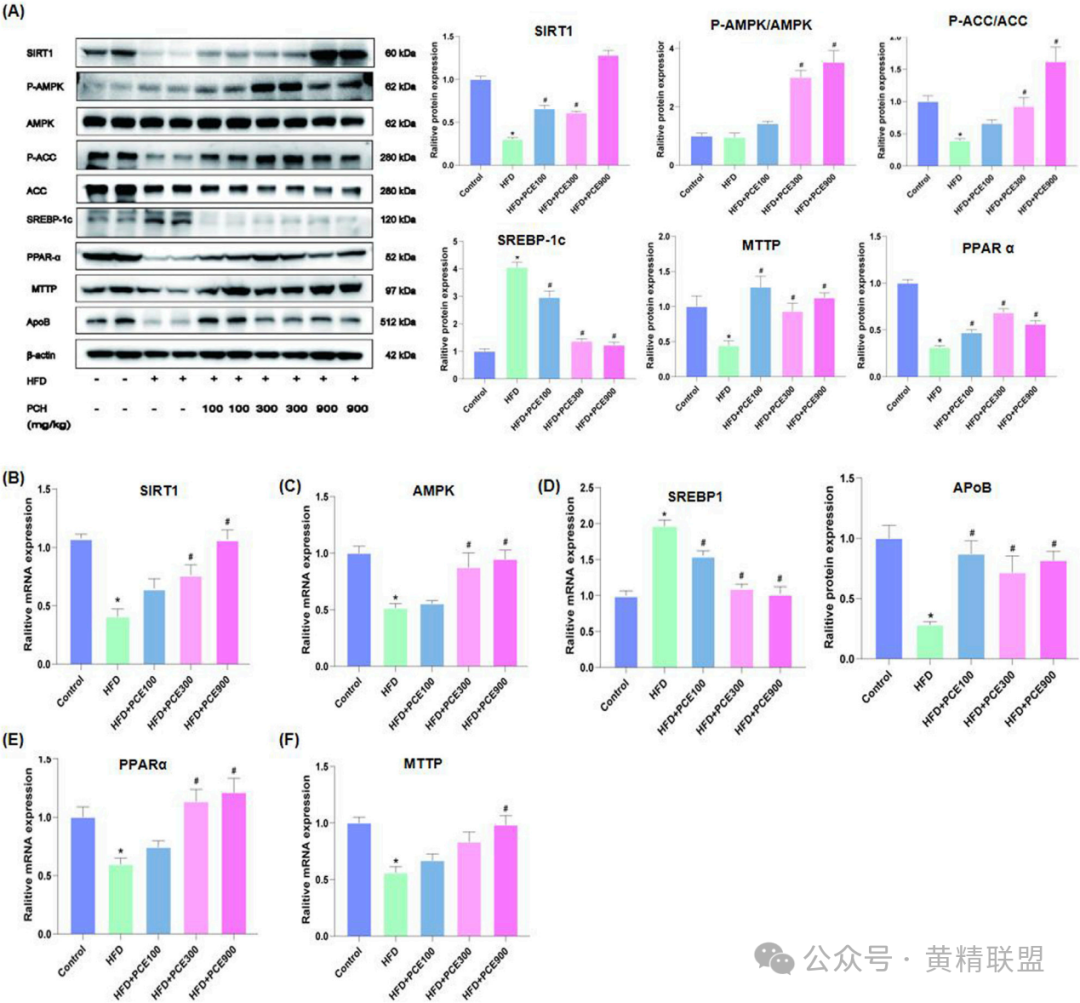
图4 PCE治疗激活了AMPK/SITR1信号通路
(A)SIRT1、AMPK、ACC、SREBP-1c、PPAR-α、MTTP的代表性西方螺栓结果,ApoB和定量结果;(B)SIRT1 mRNA相对表达水平;(C)AMPK mRNA相对表达水平;(D)mRNA相对SREBP1的表达水平;(E)PPAR-αmRNA相对表达水平;(F)MTTP的mRNA相对表达水平。
5. PCE抑制NF-κB介导的炎症反应
从蛋白水平的角度来看(图5A-E),HFD组IL-1β、TNF-α、NF-κB p65蛋白表达分别升高3.2倍、3.8倍和4.1倍,PCE高剂量组分别降至1.5倍、1.7倍和1.9倍。从mRNA水平,IL-6、TNF-α基因表达分别下降70%和65%,与SIRT1激活抑制NF-κB核转位相关。SIRT1通过去乙酰化NF-κB p65亚基(Lys310位点),阻断其与DNA结合,从而抑制炎症基因转录。
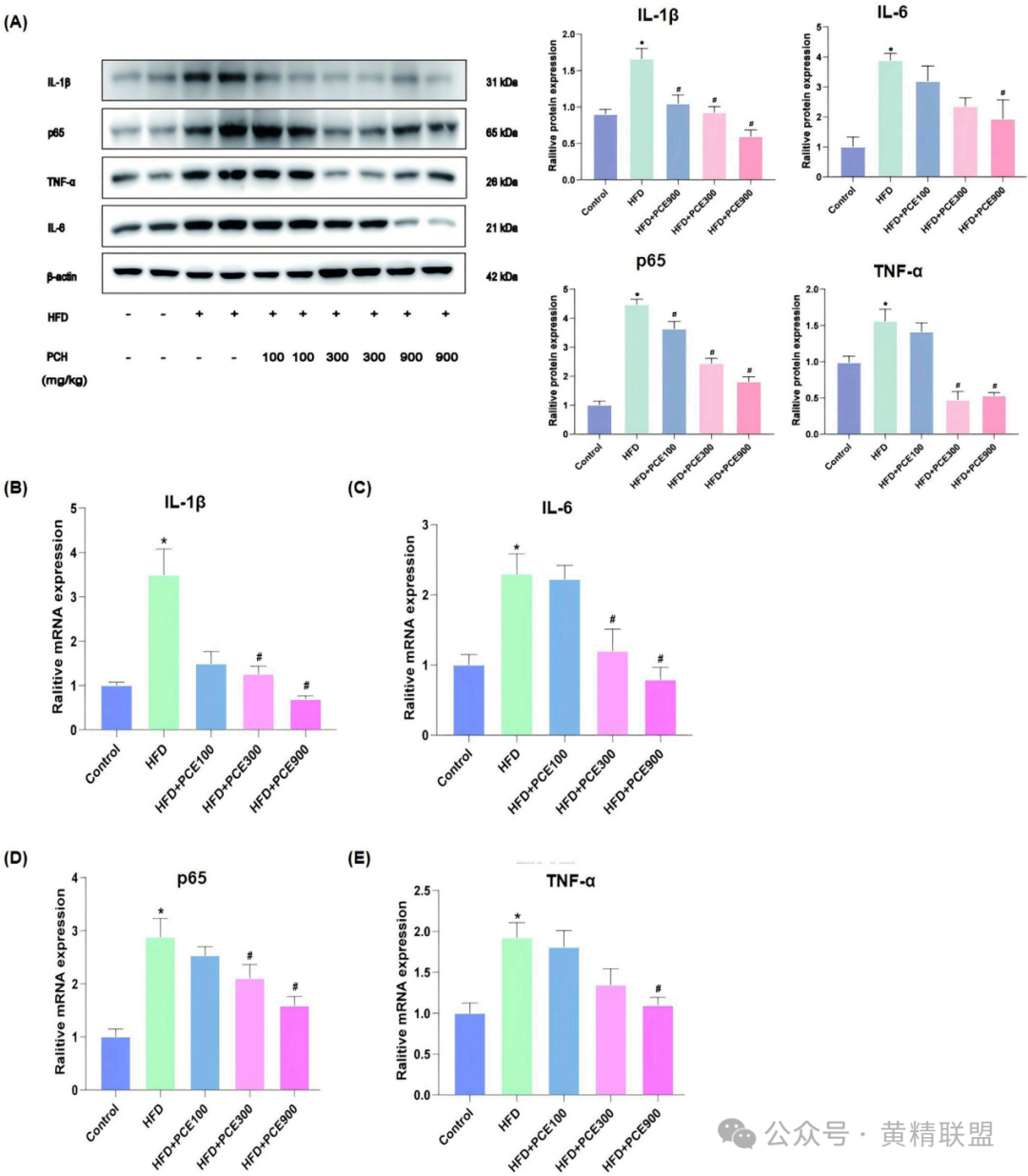
图5 PCE治疗降低HFD诱导的炎症因子的高表达
(A)IL-1β、p65、TNF-α、IL-1β和IL-6的Western blot结果;(B)IL-1βmRNA相对表达水平;(C)IL-6 mRNA相对表达水平;(D)p65的mRNA相对表达水平;(E)TNF-αmRNA相对表达水平。
6. RNA测序揭示多通路协同作用
差异表达基因(DEGs)分析(图6A-B)显示,HFD诱导的异常通路,包括“中性粒细胞脱颗粒”(促炎)、“胆固醇生物合成”(SREBP靶点)和“急性期反应信号”(炎症放大),均被PCE显著逆转。PCE激活了一些保护性通路:如“FXR/RXR信号”(胆汁酸代谢调控)、“Gap连接”(细胞间通讯)和“IL-12信号”(抗纤维化)。
上游调控因子中,促炎因子TNF、IL-6、NF-κB的调控活性被抑制;代谢调控因子FGF19(胆汁酸-FXR信号)和SCD(脂肪酸去饱和酶)表达上调,表示PCE通过多靶点重塑肝脏代谢稳态。
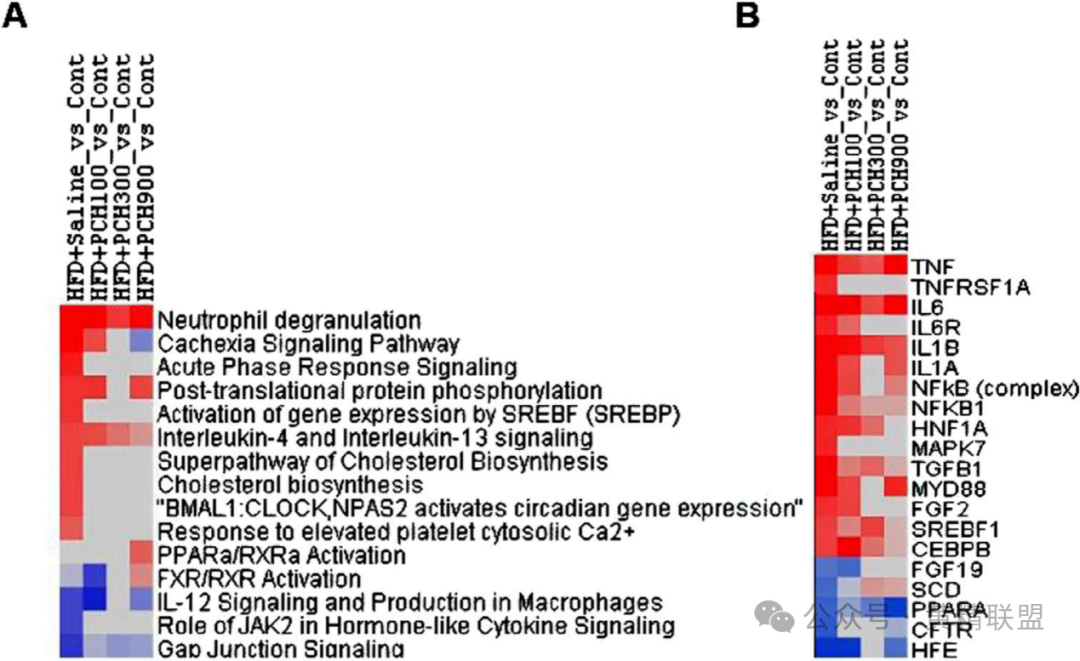
图6 对差异表达基因进行Ingenuity通路分析(IPA)
(A)主要通路;(B)主要上游调控因子。
7. 剂量依赖性效应与阳性药对比
PCE低(100 mg/kg)、中(300 mg/kg)、高(900 mg/kg)剂量组在改善肝指数、血脂水平和炎症因子表达上均呈现显著剂量依赖性。PCE高剂量组在降低ALT、AST和TG的效果与辛伐他汀(4 mg/kg)相当,但在上调HDL-C和抑制NF-κB通路上表现更优,表明其多靶点优势。
研究结果为黄精的乙醇提取物的临床应用提供坚实的实验依据,并揭示AMPK/SIRT1通路在非酒精性脂肪性肝炎治疗中的核心地位。
全文小结:
黄精醇提物能够显著改善高脂饮食诱导的小鼠非酒精性脂肪性肝炎。
1. 9种黄精醇提降脂代谢物通过AMPK/SIRT1、PPAR α、NF-κB等多靶点多组分协同作用。
2. 通过抑制脂肪合成(SREBP1/ACC)、促进脂肪酸氧化(PPARα)与脂质外排(MTTP/ApoB)的作用进行脂代谢调控。
3. 通过抑制NF-κB通路,降低IL-1β、TNF-α等炎症因子起到抗炎作用。
4. 在分子生物学方面,通过RNA的测序证实黄精醇提物能够逆转高脂饮食诱导的代谢、炎症和昼夜节律相关基因异常。
转载请在开头注明:本文转载自公众号——黄精联盟
遵义医科大学基础药理教育部重点实验室的李征副教授和李夏副教授共同为该论文的通讯作者。原文链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC11821971/