|
2017年8月29日,第十一届药典委员会成立大会暨全体委员大会在北京召开,会上部署2020年版《中国药典》编制工作。在考虑国家药品标准整体状况基础上,2020年版《中国药典》预计收载品种数6400个左右,增订品种800个,占品种总数的12.5%,其中:中药增加品种约220个,化学药增加品种约420个,生物制品增加品种收载30个,药用辅料增加品种约100个,药包材品种收载30个。修订品种1400个,占21.9%,其中:中药500个,化药600个,生物制品150个,药用辅料150个。2020版药典将适度增加品种的收载,加强对药品安全性和有效性控制方法的研究和建立,结合国家药品标准清理,逐步完善药品标准淘汰机制,健全标准体系,强化药品质量全程管理理念等。
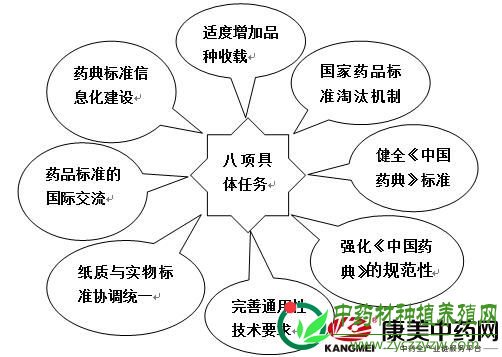
一、2020年版《中国药典》八项具体任务 药典是药品科学技术发展成果的结晶,是一个国家药品产业发展水平的标志,是药品生产经营者的基本遵循,是药品监管工作的准绳。根据《2020年版中国药典编制大纲》,2020年版《中国药典》编制工作有八项具体任务:
《中国药典》八项具体任务 1、适度增加品种的收载,进一步满足临床需要。在经过历版药典收载品种大幅增长后,现行版药典达到了基本药物、医保药品全覆盖,能够适应临床用药的需要。2020年版药典提出了品种收载适度增长,一是要考虑目录的调整,二是工作基调由注重药品的收载数量,向注重药品内在质量的提升转变; 2、结合国家药品标准清理,逐步完善药品标准淘汰机制。建立国家药品标准淘汰机制,全面清理国家已有药品标准,加大对已经取消文号、长期不生产、质量不可控、剂型不合理、稳定性不高的药品标准的淘汰力度。需要开展临床价值或风险效益评价的品种,提请相关部门进行评价; 3、健全《中国药典》标准体系,强化药品质量全程管理的理念。完善和丰富药品标准的内涵,强化过程控制,由药品终端控制向生产过程和源头控制延伸,实现药品生命周期的质量控制标准体系; 4、强化《中国药典》的规范性,进一步促进药典各部之间的统一协调。加强药典各部内容的规范统一,通用性技术要求与相关技术法规的协调统一,通用性技术要求与各部内容以及各论标准内容的统一。建立统一规范的药品、药用辅料和药包材通用名称命名原则,研究制定药品标准编码体系,制定药典名词术语。 5、完善通用性技术要求,全面展现药品质量控制水平。2020年版药典工作重点加强对药品安全性和有效性控制方法的研究和建立。加强先进的检测技术在药品质量控制中的应用; 6、推进纸质标准与实物标准的协调统一。实物标准是药品标准的标准,在标准研究起草过程中做好标准品工作的衔接,积极筛选、推荐标准品候选物,争取标准与标准品同步推出; 7、加强药品标准的国际交流与合作,促进药典标准的国际协调。以药品进出口贸易需求为导向开展标准协调工作。突出中药标准的国际主导地位,不断扩大《中国药典》和中国药品质量的国际影响力; 8、加强药典标准信息化建设,不断丰富标准服务形式。在出版纸质版的同时,同步发行电子版、手机版和网络版,加快《中国药典》标准信息服务平台的建设,进一步提升药典的社会服务功能。 二、建立科学的药品标准体系 我国药品质量疗效与美、欧、日存在差距,原因很大程度上在于药品上市标准不高,标准缺失、标准落后、标准不管用、标准执行不到位等问题也不同程度存在。 1、用严谨的标准监管药品。要加快药品标准制修订工作,建立科学、全面、可检验、能执行的标准体系,用“最严谨的标准”提高药品质量疗效,防范药品安全风险,保障群众用药安全。 2、药典要充分体现药品质量疗效。坚持“临床常用、疗效确切、使用安全、工艺成熟、质量可控”的品种遴选原则,全面覆盖国家基本药物目录、国家基本医疗保险用药目录,适应临床治疗用药指南调整变化的需要;重点增加原料药、中药材、药用辅料标准的收载;新制剂的收载,要充分体现我国医药创新成果。 3、实现药品全生命周期管理。针对药品领域改革,我国药品改革已经从审评审批制度革新逐步拓展为药品监管制度的全面变革。药品上市的基本标准就是新药要“全球新”,仿制药要与原研药质量疗效一致。要实现药品全生命周期管理,实现药品研发、加工、经销、使用全链条的监管。药品批准文件持有人要承担研发、加工、经销、不良反应监测、完善药品质量等全生命周期的法律责任。临床试验数据不真实、不完整、不可溯源的申请,一律予以退回。 三、中药材和饮片质量问题突出 2020年版《中国药典》收入大量新的品种,新的分析技术和检测手段大量用于药品的质量控制,有效提升了药品质控水平,保障了大众用药。但是,现在我国医药产业企业多、分布广、生产条件参差不齐、产品质量差异大、质控技术相对落后等现状依然存在,尤其是中药材和饮片,其质量问题依然突出, 例如: 1、2017年8月10日,上海市食品药品监督管理局发布了2017年第4期药品监督抽验质量公告。公告显示,金贵中药、天马中药等6家药企生产的7款饮片抽检不合格,不合格项目包括含量测定、性状、炮制、浸出物、黄曲霉毒素等。统计发现,性状、炮制不符合标准的饮片批次最多,共有4批; 2、2017年8月18日,国家食药监总局发布了《关于9批次中药饮片不合格的通告》。通告称,经重庆市食品药品检验检测研究院检验,标志为北京同仁堂(亳州)饮片有限责任公司等9家企业生产的9批次中药饮片不合格,不合格项目为黄曲霉毒素; 3、2017年8月28日,据国家食药监总局官网消息,内蒙古自治区食品药品监督管理局对药品质量抽检结果进行了通告,标志为亳州市豪门中药饮片有限公司等企业生产的15批次中药材及中药饮片不符合标准规定。 由此可见,药典标准制定任务依然艰巨、挑战不断。但在2020年版《中国药典》标准化要求驱动下,药品质控水平将会不断提高,药品标准的淘汰力度不断加强,逐步完善药品标准淘汰机制。强化中药材和饮片全生命周期管理理念,市场潜力无限,不断扩大《中国药典》和中国药品质量的国际影响力。 |